securPharm - Die Absicherung der pharmazeutischen Lieferkette
Ca. 10% der in Umlauf gebrachten Arzneimittel in Ländern mit geringem bis mittleren Einkommen waren 2017 gefälscht [1]. Diesem hohen Fälschungsumfang beugt das securPharm-System in Deutschland vor. Es ermöglicht, Fälschungen entlang der Lieferkette zu identifizieren und deren Abgabe zu stoppen. Die Überprüfung erfolgt EU-weit über Ländergrenzen hinweg durch ein Datenspeicher- und abrufsystem. Aufgrund einiger systembezogener Schwierigkeiten ist das System in Apotheken dennoch nicht gänzlich akzeptiert. Eine zusätzliche Problematik bildet der Onlinehandel, der nicht in gleichem Maße abgesichert werden kann wie der stationäre Handel. Ein abschließender tabellarischer Vergleich mit dem US-amerikanischen System zeigt, dass es dem europäischen in nahezu allen Punkten gleicht.
Nach dem Arztbesuch die Apotheke aufsuchen und das zuvor ausgestellte Rezept einlösen, um möglichst schnell wieder gesund zu werden – hierbei verlassen sich Kunden stets auf den hohen Qualitätsstandard von Arzneimitteln. Doch auch im Bereich des Pharmahandels existiert Kriminalität, sodass immer wieder gefälschte Arzneimittel in die pharmazeutische Lieferkette gelangen [2]. Um dieses Risiko zu minimieren wurde in Deutschland die Organisation securPharm e.V. gegründet. Diese schließt die wichtigsten Akteure der pharmazeutischen Lieferkette zu einem Netzwerk zusammen, um gemeinsam dem Eindringen von Arzneimittelfälschungen in diese vorzubeugen [3]. Dieses System wird im Folgenden näher betrachtet, mittels einer nicht repräsentativen Umfrage kritisch bewertet und mit dem System der USA verglichen. Hierbei soll anhand einer detaillierten Literaturrecherche die Frage beantwortet werden, wie die pharmazeutische Lieferkette mittels securPharm abgesichert werden kann.
Fälschungen in der pharmazeutischen Lieferkette
Laut der WHO waren im Jahr 2017 in Ländern mit geringem bis mittleren Einkommen ca. 10% der in Umlauf gebrachten Arzneimittel gefälscht bzw. minderwertig [1]. In Deutschland gab es im Jahr 2017 lediglich eine geringe Zahl an Fälschungen, welche vom Bundesinstitut für Arzneimittel und Medizinprodukte (BfArM) entdeckt wurden. Dennoch ist von einer Dunkelziffer auszugehen, sodass die eigentliche Anzahl der gefälschten Arzneimittel in der deutschen Lieferkette deutlich höher liegen kann [4].
Der Begriff Fälschung bezieht sich im Folgenden auf Arzneimittel, bei denen die Identität oder Angaben zur Herstellung bzw. zum Vertriebsweg gefälscht wurden. Minderwertige Produkte, also solche bei denen während des Herstellungsprozesses eine mangelhafte Sorgfalt vorherrscht [5], gelten nur dann als Fälschung, wenn ein vorsätzliches Einschleusen dieser in die pharmazeutische Lieferkette erfolgt [6]. Die Einnahme kann tödlich sein, da diese teilweise den falschen oder überhaupt keinen Wirkstoff enthalten und somit schwerwiegende Krankheiten unwissentlich nicht weiter therapiert werden [5]. In diesen Fällen treten häufig unspezifische Symptome auf, sodass die Fälschungen meist unentdeckt bleiben [7].
Die Beweggründe für den Handel mit gefälschten Arzneimitteln liegen auf der Hand: Er ist äußerst lukrativ und lässt einen hohen Profit erwarten, sodass die Gewinne aus deren Produktion und Handel sogar die des illegalen Drogenhandels übersteigen können. Der Wert der daraus hervorgeht liegt Schätzungen zufolge bei 75 Milliarden US-Dollar pro Jahr [8]. Ferner kann eine schwache Regierung, welche durch mangelnde Regularien oder Korruption geprägt ist, zu einem erhöhten Fälschungsaufkommen in den betroffenen Ländern führen. Auch eine mangelnde Rückverfolgbarkeit sowie ein eingeschränkter Zugriff von Arzneimitteln durch mangelnde Finanzierbarkeit bzw. Verfügbarkeit, stellen den idealen Nährboden für Handel mit gefälschten oder minderwertigen Arzneimitteln dar [9].
SecurPharm-System
SecurPharm e.V. ist eine Organisation, bestehend aus unterschiedlichen Parteien des Arzneimittelvertriebs [3], welche ein Sicherungssystem als nicht gewinnorientierte Rechtspersonen einrichten und verwalten [10]. Sie agiert dabei als Teil eines gesamteuropäischen Systems. Ziel dessen ist es, Fälschungen entlang der Lieferkette, mittels einer End-to-End-Verifikation und dem Anbringen von Sicherheitsmerkmalen zu identifizieren und zu melden [10]. Dabei basiert das System auf der Prüfungsform der EU-Fälschungsrichtlinie 2011/62/EU, der DIN EN 16679 Norm sowie der delegierten Verordnung (EU) Nr. 2016/161. Diese rechtlichen Grundlagen geben Sicherheitsmerkmale zur besseren Erkennung gefälschter Arzneimittel vor. Mit ebenjenen müssen zum einen verschreibungspflichtige Arzneimittel mit Ausnahme weniger, welche auf der sogenannten White List vermerkt sind, versehen werden. Ebenso sind wenige nicht-verschreibungspflichtige Arzneimittel, als Teil der Black List, betroffen [11]. Die auf den Listen vermerkten Ausnahmen resultieren aus verschiedenen Einflussfaktoren wie dem Preis, dem Absatzvolumen oder der Anzahl bzw. Häufigkeit der Fälschungen und folglich dem Fälschungsrisiko [6].
Eigenschaften der Sicherheitsmerkmale
Die Sicherheitsmerkmale zum Schutz der Arzneimittel vor Manipulation werden auf der jeweiligen Umhüllung oder Primärverpackung [10] durch den pharmazeutischen Hersteller angebracht [3]. Den ersten Teil des individuellen Erkennungsmerkmals bildet der „Unique Identifier“, welcher den Produktcode, die Serien-, Chargen- und Kostenerstattungsnummer sowie das Verfallsdatum enthält. Ein DataMatrix-Code (DMC) fungiert als dessen Träger und kann mittels eines Scanners ausgelesen werden. Als zweites Sicherheitsmerkmal ist ein „Anti-Tampering Device“, ein Erstöffnungsschutz der äußeren Verpackung, angebracht [11]. Das individuelle Erkennungsmerkmal wird dabei nach standardisierter Datenstruktur und Syntax kodiert, zur Gewährleistung der weltweiten Individualität. Der Produktcode enthält Informationen über Name, Bezeichnung, Darreichungsform, Stärke, Packungsgröße und Verpackungsart. Ist die nationale Kostenerstattungsnummer bereits im Produktcode enthalten, bedarf es keiner Wiederholung dieser auf der Packung. Die Seriennummer wird nach speziellen Randomisierungsregeln, mit einer Ableitungswahrscheinlichkeit von lediglich 1:10000, generiert. Der DMC ist mindestens ein Jahr nach dem Verfallsdatum sowie mindestens fünf Jahre ab dem Inverkehrbringen individuell. Die Merkmale des Codes werden zusätzlich in ein für Menschen lesbares Format aufgedruckt, um eine Verifikationsabfrage, Deaktivierung des DMC und Abgabe des Arzneimittels bei Nichtlesbarkeit des Codes zu gewährleisten. Somit kann bei der Abgabe an den Kunden ein schneller und sicherer Abgleich gewährleistet und das sichere Anzeigen von Fälschungen garantiert werden.
Darüber hinaus haben die Behörden Zugriff auf die Software und somit Einblick in alle Schritte entlang der Lieferkette [10].
Datenspeicher und -abrufsystem mit Verbindung zum EU-Hub
Die Abwicklung der verschiedenen Prozessschritte von der Anbringung des individuellen Erkennungsmerkmals am Beginn der Lieferkette, über die Überprüfung entlang der Lieferkette bis hin zur finalen Verifikation bei der Abgabe an die Öffentlichkeit, erfolgt über ein Datenspeicher und -abrufsystem, welches auf nationaler und supranationaler Ebene agiert. Es umfasst das Hochladen der Datenelemente des jeweiligen individuellen Erkennungsmerkmals, sowie Informationen über das Arzneimittel. Darüber hinaus enthält das System Daten der Arzneimittelhersteller und -großhändler. Es ist außerdem mit einem Hub, als Informationsund Datenrouter verbunden, welcher im ständigen Datenaustausch mit dem System steht. Dieser bildet eine zusätzliche Absicherung, wenn eine Abfrage nicht möglich ist. Die Überprüfung findet zu 95 % in unter 300 Millisekunden statt, ungeachtet der Internetverbindung, was die hohe Übermittlungsgeschwindigkeit verdeutlicht. Über die Überprüfung in Echtheit hinaus, zeigt das System zudem an, ob ein Arzneimittel zurückgerufen, vom Markt genommen oder gestohlen wurde [10].
Der beschriebene Ablauf entlang der pharmazeutischen Lieferkette ist im Modell in Bild 1 beschrieben. Dieses verdeutlicht die Verbindung zum EU-Hub aus dem EU-Ausland sowie seine Verbindung zum nationalen Verifikationssystem. Weiter veranschaulicht es die Transportwege aus dem Aus- ins Inland und die Zuständigkeiten der Überprüfung vor Abgabe an den Patienten durch den Großhändler sowie Apotheken.
Zudem zeigt das Modell, dass die Stelle in der Lieferkette, an welcher die Fälschung eingeschleust wurde, durch den ständigen Austausch mit dem nationalen Verifikationssystem, identifiziert werden kann [3].
Bild 1: securPharm End-to-End-Verifikationssystem [12-14].
Kritische Bewertung des securPharm-Systems
Bei einer nicht repräsentativen Umfrage zehn verschiedener Apotheken in Stuttgart wurde das neue securPharm-System in Bezug auf die Häufigkeit des Auftretens von Fälschungen und die Integrationsfähigkeit in den laufenden Prozess kritisch beleuchtet, sowie generelle Kritik und Verbesserungsvorschläge erfragt. Das Ergebnis zeigt, dass das System zwischen monatlich (3x) über quartalsweise (1x) bis nie (6x) eine Fälschung anzeigt, was meist auf Rückbuchungen oder die Nichterreichbarkeit des Servers zurückzuführen ist. Die Häufigkeit der Fälschungen macht deutlich, dass die Arzneimittel beim Eintreffen in den Apotheken bereits ausführlich überprüft werden, sodass dort kaum gefälschte Ware eintrifft. Die Nichterreichbarkeit sowie das zusätzliche Einscannen des DMC verlangsamen bei sieben von zehn befragten Apotheken den Prozessfluss. Dieses steht im Widerspruch mit der versprochenen Überprüfungsgeschwindigkeit im System. Ebenso mangelnde Druckqualität des Codes bzw. der Klarschrift können Störungen und somit Mehraufwand verursachen. Des Weiteren wurde der Verbesserungsvorschlag angeführt, das System weltweit geltend zu machen, um globale Gleichheit und Sicherheit zu gewährleisten. Dennoch wurde durch die Befragung deutlich, dass das System zum Zwecke der Absicherung als sinnvoll erachtet wird.
Grenzen der Absicherung im Onlinehandel
Die jährlich von Interpol durchgeführte “Pangea Operation”, soll den Internethandel gefälschter Arzneimittel auf globaler Ebene aktiv eindämmen. Allein durch die Razzia “Pangea XIII” im März 2020 wurden 4,4 Millionen Einheiten gefälschter Arzneimittel im Wert von 14 Mio. US-Dollar beschlagnahmt. Zudem kam es zu 121 Festnahmen und dem Herunterfahren von mehr als 2500 Websites [15]. Diesen hohen Fallzahlen liegen verschiedene Ursachen, wie der geringe Verfolgungsdruck und das vorherrschende geringe Entdeckungsrisiko, zugrunde. Das größere Problem ergibt sich allerdings aus der Tatsache, dass die Sicherheitsmerkmale, mit denen die legalen Internetapotheken gekennzeichnet werden, von den Kunden häufig nicht ge- und erkannt werden [16]. Bei diesen Sicherheitsmerkmalen handelt es sich zum einen um ein unionweit eingesetztes, harmonisiertes Sicherheitslogo, welches sich lediglich durch die Flagge des Mitgliedsstaats unterscheidet, in welchem die Online-Apotheke ansässig ist [17]. Durch das Klicken auf das Sicherheitslogo findet eine Weiterleitung zur Website mit Informationen über die natürliche oder juristische Person hinter der jeweiligen Online-Apotheke statt. Zudem müssen die Websites der Online-Apotheken die Kontaktdaten der zuständigen Behörde, sowie eine Verknüpfung zur Website des Niederlassungsstaats aufweisen [6]. Bereits im Jahre 2016 erwarben 55 % der deutschen Internetnutzer Arzneimittel online [18]. Dies macht deutlich, dass eine weitere Sensibilisierung bezüglich des Sicherheitslogos und dessen Bedeutung notwendig ist, um den Onlinehandel gleichermaßen, zum stationären Handel, zu schützen.
Vergleich mit dem US-amerikanischen System
Das Sicherungssystem der EU ist seit dem 09.02.2019 [11] in allen Staaten des EWR vertreten, mit Ausnahme von Italien und Griechenland, welche im Jahre 2025 folgen werden [19-20]. Weitere Mitglieder des European Medicines Verification Systems (EMVS) sind die Schweiz und das Vereinigte Königreich [19-20]. Wie in Bild 1 zu sehen, besitzen ebenjene Mitglieder einen Zugang zum EU-Hub in welchem Informationen, wie Herstellungserlaubnisse oder Genehmigungen der Großhändler, hinterlegt sind. Außerdem verfügen sie, wie Deutschland, über eigene nationale Systeme zur Verhinderung des Einschleusens gefälschter Arzneimittel in die legale Lieferkette [6].
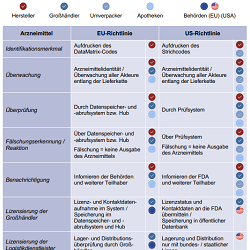
Bild 2: Vergleich EU- vs. US-Richtlinie zur Fälschungssicherheit entlang
der pharmazeutischen Lieferkette [6, 12, 23, 24].
Das Sicherungssystem der USA beinhaltet, ebenso wie das Europäische, die Absicherung von Fälschungen verschreibungspflichtiger Arzneimittel über einen „Product Identifier“ [21]. Die Regularien zur Überprüfung und Sicherung der Arzneimittel entlang der Lieferkette werden durch den Drug Supply Chain Security Act (DSCSA) definiert, welcher 2014 in Kraft trat und einen weiteren schrittweisen Ausbau bis 2023 vorsieht [22]. Aus der Tabelle in Bild 2 kann entnommen werden, dass das System der USA dem Europäischen in nahezu allen Gesetzespunkten gleicht. Lediglich die Lizensierung der Logistikdienstleister und das gesetzliche Einbinden des Akteurs „Umverpacker“ weichen von dem EU-Sicherungssystem ab [10, 23].
In der Gegenüberstellung wird in der Spalte „Arzneimittel“ die jeweilige Aktion in Bezug auf die Sicherung entlang der pharmazeutischen Lieferkette beschrieben. Die farblichen Markierungen zeigen dabei an, welche Institution die Aktion jeweils durchführt. Unter EU- und US-Richtlinie wird beschrieben, welche Vorgaben jeweils erfüllt werden müssen.
Fazit und Ausblick
Das securPharm-System ist maßgeblich am Schutz der pharmazeutischen Lieferkette in Deutschland beteiligt. Dabei fügt es sich harmonisch in das europäische System ein und trägt somit zur Sicherung auch über Ländergrenzen hinweg bei. Dennoch werden Grenzen des Systems durch die mangelnde Sensibilisierung für die Sicherheitsmerkmale im Bereich des Onlinehandels sichtbar. Im internationalen Vergleich mit den USA wird deutlich, dass die Komponenten der verschiedenen Sicherungssysteme ähnlich ausgewählt sind. Die überschaubaren Nachteile des Systems, hinsichtlich der Verlangsamung des Prozesses und der generellen Handhabung an den Abgabestellen, kann durch die einwandfreie Sicherung in Kauf genommen werden. Zur weiteren Prävention von Arzneimittelfälschungen wäre ein weltweit einheitliches System wünschenswert, wobei der Grundstein durch die aufgezeigte Ähnlichkeit der verglichenen Systeme bereits gelegt ist.
Schlüsselwörter:
Arzneimittelfälschungen, securPharm e.V., Arzneimittellogistik, ArzneimittelüberwachungLiteratur:
[1] World Health Organisation: 1 in 10 medical products in developing countries is substandard or falsified. 2017.
[2] Wiegard, A.; Heuermann, M.: Die Rolle der deutschen amtlichen Arzneimitteluntersuchungsstellen bei der Bekämpfung von Arzneimittelfälschungen. In: Bundesgesundheitsblatt, Gesundheitsforschung, Gesundheitsschutz 60 (2017) 11, S. 1214–20.
[3] securPharm e.V.: Securpharm e.V. URL: www.securpharm.de. Abrufdatum 19.05.2020.
[4] Wittstock, M; Paeschke, N.: Aktuelle Fälschungsfälle bei Arzneimitteln in der Zuständigkeit des Bundesinstituts für Arzneimittel und Medizinprodukte (BfArM). Fallbeispiele und Ausmaß. In Bundesgesundheitsblatt, Gesundheitsforschung, Gesundheitsschutz 60 (2017) 11, S. 1196–202. [5] Vorrath, J.; Voss, M.: Die unterschätzten Gefahren gefälschter und minderwertiger Medikamente. In: SWP-Aktuell (2019) 30, S. 1-4.
[6] Richtlinie 2011/62/EU des Europäischen Parlaments und des Rates. 2011.
[7] Venhuis, B. J.; Mosimann, R.; Scammell, L.; Digiorgio, D.; van Cauwenberghe, R.; Moester, M. G. A. M.; Arieli, M.; Walser, S.: Identification of health damage caused by Medicrime products in Europe. An exploratory study, RIVM Report 040003001/2012 2013.
[8] Europol; Office for Harmonization in the Internal Market: 2015 Situation Report on Counterfeiting in the European Union. A joint project between Europol and the Office for Harmonization in the Internal Market. 2015.
[9] World Health Organisation: WHO Global Surveillance and Monitoring System for substandard and falsified medical products. Geneva 2017. [10]Delegierte Verordnung (EU) 2016/161 der Kommission. 2015.
[11] Bergen, M.; Hoferichter, R.: securPharm e. V. – der Schutzschild gegen gefälschte Arzneimittel. In: Bundesgesundheitsblatt, Gesundheitsforschung, Gesundheitsschutz 60 (2017) 11, S. 1255–60.
[12] Freepik: Flaticon. URL: www. flaticon.com/authors/freepik, Abrufdatum 01.06.2020.
[13]Gouda, M.: Pharamceutical Distribution in Europe - The Drivers and Challanges of Distributing Pharmaceutical Products in the European Market. In: Stoller, C. W. (Hrsg): Pharmalogistik. Prozesse - Instrumente - Praxisbeispiele. Wiesbaden 2017.
[14]securPharm e.V.: End-To-End Verifikation. URL: www.securpharm.de/wp-content/ uploads/2018/08/2018-10-01- End-To-End-DE.jpg, Abrufdatum 01.06.2020.
[15] Interpol: Pharmaceutical crime operations.
[16] Sinn, A.; Berg, M.: Das Europäische Sicherheitslogo für Online-Apotheken und die Maßnahmen zur Absicherung der legalen Arzneimittellieferkette. In: Sinn, A.; Hartmann, B. J.; Liebl, K.; Schmitz, R.; Schulte-Nölke, H.; Steinebach, M. (Hrsg): Auswirkungen der Liberalisierung des Internethandels in Europa auf die Arzneimittelkriminalität. Berlin Heidelberg 2019.
[17] bitkom: Medikamtente kauft mehr als jeder zweite Internetnutzer online. 2016.
[18]securPharm e.V.: Fälschungsschutz: Ein Jahr digitaler Ausweis für mittlerweile eine Milliarde Arzneimittelverpackungen in Deutschland. 2020.
[19] European Medicines Verification Organisation: EMVS Countries. URL: https://emvo-medicines.eu/mission/ emvs/#countries, Abrufdatum 25.05.2020.
[20]U.S. Food & Drug Administration: Should this drug package or case have a product identifier under the Drug Supply Chain Security Act? URL: www. fda.gov/media/116363/download, Abrufdatum 25.05.2020.
[21]U.S. Food & Drug Administration: Are you ready for the Drug Supply Chain Security Act? URL: www.fda.gov/drugs/ drug-supply-chain-security-act-dscsa/are-you-readydrug-supply-chain-securityact, Abrufdatum 25.05.2020.
[22]U.S. Food & Drug Administration: Key Provisions of the Drug Supply Chain Security Act. URL: www.fda.gov/ drugs/drug-supply-chain-security-act-dscsa/key-provisions-drug-supply-chain-security-act, Abrufdatum 25.05.2020.
[23] Europäische Union: Leitlinien vom 05. November 2013 für die gute Vertriebspraxis von Humanarzneimitteln. 2013.
